Batarya Teknolojileri
Batarya (Akü) Teknolojilerinde Temel Kavramlar
Enerji Yoğunluğu (Energy Density):
Akünün birim ağırlığında veya birim hacminde depolayabileceği elektrik enerjisi miktarına Enerji Yoğunluğu adı verilir.
“Gravimetrik enerji yoğunluğu (Gravimetric energy density) “1 Kg aküde kaç Wh (watt saat) enerji depolanabileceğini belirtir ve Wh/Kg birimi ile gösterilir bazı üreticiler Ah/Kg gibi birimler de kullanır bu birimin enerjiye dönüştürülmesi için ilgili akünün kutup voltajı ile Ah/Kg değerinin çarpılması gerekir.
“Volümetrik enerji yoğunluğu” (Volumetric energy density) ise “1 Litre hacimde kaç Wh enerji depolanabileceğini belirtir ve Wh/Lt. olarak gösterilir. Akülerde “yüksek enerji yoğunluğu” istenir.
Şarj Verimliliği (Charge efficiency):
Diğer bir söylemle “Enerji verimliliği” (Energy efficiency) de denilen bu parametre akünün tam şarjlı bir aküden tam deşarj olana kadar çekilen enerji miktarının, aynı akünün yeniden tam şarj edilmesi için aküye verilen enerji miktarına oranı olarak tanımlanır.
%100’den düşük bir rakamdır. Olabildiğince yüksek olması istenir. Sonuçta şarj sırasında verilen enerji ile aküden deşarjda çekilen enerji arasındaki fark akü içerisinde “kayıp” edilen bir enerjidir.
Deşarj Derinliği (Dept of Discharge-DoD):
Akünün %100 dolu durumundan %0 tam boş durumuna kadar olan deşarj edilme oranıdır. %80 DoD demek akünün Ah olarak belirtilen kapasitesinin %80’ine kadar deşarj edilmesi anlamına gelir.
Şarj Durumu (State of Charge-SoC):
Akünün % olarak doluluk oranını ifade eder. Genellikle akü kutup başlarındaki gerilim ile SoC değeri arasındaki ilişki akünün teknolojisine göre değişir.
Çevrim Ömrü (Cycle Life):
Akünün belli bir DoD seviyesine kadar deşarj ve sonra tam şarj edilmesine bir “çevrim” denir. Akü Ah olarak belirtilen kapasitesini %80’e kadar koruyacak şekilde kaç kez şarj/deşarj “çevrimine” sokulabiliyor ise o akünün “çevrim ömrü” o sayıya eşittir. Yani bir X Ah bir akü kaç kez şarj deşarj edilirse 0.8 X Ah kapasiteye düşüyor ise o sayı çevrim ömrü sayısıdır. Ancak çevrim ömrü sayısının gösteriminde mutlaka çalışma sıcaklığı ve DoD değerlerinin de birlikte söylenmesi gerekir. Örneğin %20 DoD ve 25 oC’deki çevrim ömrü ile %80 DoD ve 40 oC’deki çevrim ömrü birbirinden çok farklı sayılar olabilir.
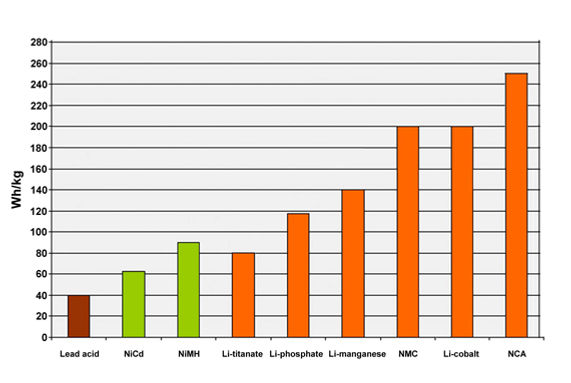
Kurşun Asit Aküler
Elektro Kimyasal Yapı
Kurşun-asit en eski ve en üzerinde en çok geliştirme yapılmış akü teknolojilerinden biridir. Güç kalitesi ve uygun maliyeti nedeniyle en popüler elektrik depolama alternatifidir.
Nispeten düşük şarj/deşarj çevrim ömürleri (500-800) temel dezavantajını oluşturur. 25-40 Wh/kg (Gravimetrik) ve 60-75 Wh/lt. (Volümetrik) enerji yoğunluğu ve %80-90 şarj verimliliği ile kabul edilebilir bir performansa sahiptirler.
Deşarj Sırasındaki Kimyasal Reaksiyon
Pozitif plakayı oluşturan kurşun oksit (PbO2) malzemesi elektriksel olarak yüksek potansiyele (1.69V) ve negatif plakayı oluşturan kurşun (Pb) malzemesi ise tersine düşük potansiyele sahiptir (-0.358 V). Akünün kutupları elektrik akımı akabilecek bir yüke bağlandığında plakalar arasındaki bu potansiyel farkı nedeniyle elektrolitte iyonlaşmalara sebep olarak sülfürik asit (H2SO4 ) ve su (H2O) moleküllerinin iyonlarına ayrılıp H+ , SO42- , OH- oluşmasına neden olur.
H2SO4 --> 2H+ , SO42- H2O --> H+ + OH-
Bu süreçte pozitif iyonlar (H+) pozitif elektrota, negatif iyonlar (OH-) ise negatif elektrota doğru akmaya başlar ve bu akü içersinde pozitif elektrottan negatife bir akım oluşmasını sağlar. Bu bağlamda pozitif elektrotta bir “indirgeme” (reduction) ve negatif elektrotta “yükseltgenme-oksidasyon” (oxidation) reaksiyonu meydana gelir.
Pozitif Elektrot: PbO2 +4H+ +SO42- +2e --> PbSO4 +2H2 O
Negatif Elektrot: Pb + SO42- -2e --> PbSO4
Oksijen Rekombinasyonu
Pozitif ve negatif plakalar arasındaki ayırıcı malzeme (AGM veya Jel) içerisinde gaz geçişini sağlayabilecek geçitler bulunur. Şarj sırasında pozitif plakada üretilen oksijen bu geçitlerden geçerek negatif elektrota gelir ve hidrojen henüz plakadan ayrılmadan süngersi kurşun plaka ile reaksiyona girer. Bu sayede oksijen hidrojenle birleşerek (recombination) elektrolite su olarak geri döner.
Diğer yandan negatif plakada PbSO4 oluşumu nedeniyle polarizasyon potansiyeli düşer ve hidrojen gazının oluşumunu önleyerek VRLA aküdeki valflerden gaz çıkışına neden olacak basınç artışına sebep kalmaz.
O2 + H2SO4 +2Pb --> 2PbSO4 +2H2O
Elektriksel Özellikler
Temel kimyasal tepkimeler sırasında kurşun ve kurşun dioksit’ten oluşan elektrotlarda deşarj sırasında iyonların bağlanması ve çözülmesi nedeniyle fiziksel olarak şekil değişiklikler oluşur. Bu değişiklikler zamanla plakaları malzeme kaybetmesine ve dolayısı ile eskisi kadar iyi performans vermemesine sebep olur.
Kurşun asit aküler 20 °C civarlarında iyi performans gösterirken sıcaklığın 40 °C’leri aşması sonrasında (özellikle AGM aküler) elektrolit ve elektrot plakalarda kalıcı hasarlar oluştuğundan çok sıcak koşullarda çalıştırılması uygun olmayan akülerdir. Temel olarak sıcaklıktaki her 10 °C artış akü ömrünün yarıya inmesine sebep olur. Özellikle VRLA tipi akülerde içindeki elektrolit ve kurşun elektrotların değiştirilmesi pratik olmadığından akünün yüksek ısıl koşullarda çalıştırılması ömürlerini ciddi düşürmektedir.
Kurşun Asit akülerde açık devre gerilimi 2.1-2.2 V civarında olan “hücre”lerde seri olarak iç bağlantılar yapılarak 6V, 12V, 24V gibi değişik kutup voltajlarında aküler üretilir.
Hücre gerilimlerinin 1.80V’un altına inmemesine özen gösterilecek şekilde deşarj edilmeleri ömürlerini uzatır. 1.7 V’ların altına inecek şekilde çok defalar “derin deşarj” edilen aküler yeniden şarj edildiklerinde eskisi kadar enerji depolayamamaya başlar. Bu da örneğin 100 Ah olması gereken akü kapasitesinin zamanla 90, 80 veya 60 Ah’ler seviyesine düşmesine sebep olur.

- VRLA akülerin etiketlerinde yazan Ah (Amper saat) değerleri 20 °C ‘de akü hücre gerilimi 1.8V’a düşecek kadar 10 saat deşarjda verebileceği akımı gösterecek kapasite değeri olarak yazılır. Bu da C10 olarak gösterilir. Yani 1000 Ah C10 olarak belirtilen bir aküden 10 saat 100 A sürekli çekildiğinde akü hücre gerilimi 1.8’a düşer“ anlamına gelir.
- Benzer mantıkla C2 , C5, C20 tipinde aküler de bulunmaktadır. Cx birimindeki x değeri küçüldükçe akünün aynı sürede verebileceği akım miktarı yükselmektedir. Yani C5 olarak 1000 Ah verilen aküden 5 saat 200 A çekilebilir. Dolayısı ile x küçüldükçe akünün kalitesi ve fiyatı artmaktadır.
- Bazı üreticilerin dokümantasyonları ve literatürde deşarj akımını ifade etmek için “C/x” parametresi kullanılır. Burada C akünün Ah kapasite değeri, x ise kaç saat deşarj edileceğidir. Örneğin 100Ah bir akü için “C/4 ile deşarj edildiğinde” demek 100/4 = 25 A ile deşarj etmek anlamına gelir.
- Akü kataloglarında şarj ve deşarj akımlarını grafiklerle gösterirken Ix şeklinde parametreler kullanılır. Örneğin 2V 1000 Ah bir akü için I10 değeri 100 A’dir. Bu bağlamda akünün verilen bir şarj eğrisinde "0.2 I10 değeri ile şarj edildiğindeki grafiktir" dendiğinde bu akım değerinin %20’sine eşit olan 20 A sabit akımla şarj edildiğinde denilmek istenir.
Akü kataloglarında şarj akımları için verilen örneğin I10 gibi değerler akünün C10 kapasite reytingine göre örneğin 100Ah olduğu akü için 100/10=10A anlamına gelir. Üreticiler şarj akımı için bir maksimum değer verirler (2.5 x I10 gibi). Ayrıca I10 un çeşitli katları ve kesirleri için de grafikler verilir (aşağıdaki şekil).

Bu şeklide göre kapasitesinin %20’si kullanılmış bir akü I10 akımı ile şarj edilirse yaklaşık 3 saatte 2.4V sınır gerilimine ulaşacaktır. Bunun için 0.2 yazan kırmızı çizgi takip edilir. Benzer şekilde %100 deşarj edilmiş bir akü 1.0 eğrisi takip edilerek örneğin I10 akımının 2 katı ile 6 saate 2.4V şarj kesme gerilimine gelecek şekilde şarj edilebilir.
AGM (Absorbed Glass Mat) tipi VRLA akülerde 1/3 oranında asit ve 2/3 oranında su içeren elektrolit fiber liflerden yapılmış beze emdirilerek elektrotlar arasına sıkıştırılır. Bu sayede akü vibrasyonlara karşı da dayanıklı hale gelir ve ortamda sıvı halde elektrolit kalmaz. Jel tip akülerde elektrolit silisyum dioksit tabanlı bir jel malzeme içine emdirilmiş şekilde akünün elektrot plakalarının arasını doldurur.

Fiber Glass Mat
Jel akülerin şarj/deşarj çevrim ömürleri AGM akülere göre yaklaşık 2 kat daha iyidir. Ancak yapıları gereği ani ve yüksek akım gerektiren uygulamalarda AGM akülere göre daha kötü performans gösterirler.
AGM tip akülerin hacimsel enerji yoğunluğu Jel’e göre daha iyidir. Diğer yandan Jel akülerin derin deşarj ömürleri AGM’e göre daha yüksektir.
AGM aküler Jel akülere göre daha az gaz çıkışına sebep olur. Jel akülerde gaz geri dönüşümü %85-95 iken AGM akülerde bu oran %97’lerdedir.
Jel aküler yüksek sıcaklıklarda AGM akülere kıyasla daha iyi performans gösterir. Diğer yandan sıfır derecenin altındaki koşullarda da AGM aküler Jel akülere göre daha iyi performans göstermektedir. Tam şarjlı bir akü deşarj olmuş bir aküye oranla daha düşük sıcaklıklarda depolanabilir. Örneğin tam dolu akü -55..-60 °C'lere kadar depolanabilirken, deşarj olmuş bir akü en düşük -20..-25 °C’ye kadar düşük sıcaklıkta depolanabilir.
Kurşun asit aküler şarjlı durumda depolansalar bile zamanla plakalarına Sülfat iyonları yavaş yavaş yapışmaya başlar. Bu nedenle aküler “kendiliğinden deşarj olur”. Jel akülerin kendi kendine deşarj (self discharge) karakteristikleri AGM’lere göre 2-3 kat daha iyidir. Jel aküler 1 yılda %20 deşarj olurken AGM aküler 6 ayda %20-30 deşarj olabilirler.
Kurşun asit akülerin uzun süreler düşük şarj seviyelerinde bırakılması "Sülfatlaşma" adı verilen bir fenomene sebep olur. Kurşun Sülfat molekülleri önce amorf yapıda birikir ve şarj edilmezse katı sülfat kristallerine dönüşür. Henüz katı kristale dönüşmemiş durumdaki sülfatlaşmaya "geri döndürülebilir sülfatlaşma" denir. Bu durum akünün 2-3 hafta şarj edilmeden düşük şarjda bırakılmasıyla oluşur. Oluşan amorf sülfat tabakası, akünün tam şarj edildikten sonra 2.5 ila 2.66 V/hücre gerilimine denk gelecek şekilde "overcharge" edilmesi ile geri döndürülebilir. Bu sayede sülfat iyonları kurşundan koparak yeniden elektrolite geri dönerler. Ancak sülfatlaşma katı kristaller oluşacak kadar uzun sürmüşse "geri döndürülemez sülfatlaşma" oluşur. Overcharge etmek katı sülfat kristallerini çözemez ve batarya Ah olarak kapasite kaybeder. Çünkü şarj/deşarj'da iyon transferi için gereken SO4 iyonları artık elektrolitte değildir ve reaksiyona girmedikleri için elektrolitteki asit yoğunluğu düşer. Bu da Ah kapasitenin azalması olarak algılanır.

Kurşun Elektrot Plakaları
Kurşun-Karbon Aküler
Kurşun ve Kurşun oksit içeren katot/anot çiftine sahip olan Kurşun-Asit akülerde önemli bir sorun olan PbO2 anot plakasındaki "Sülfatlaşma" akünün çevrim ömrünü kısaltan ve kapasite kaybını artıran bir unsur olarak yıllardır çözülmeye çalışılan bir konudur. Diğer yandan "Süper Kapasitör" uygulamalarında kullanılan Karbon anot'ların avantajı bilinmektedir. Son yıllardan "Gelişmiş Kurşun Asit" adı verilen teknolojiler ile Kurşun Katota karşılık Kurşun-oksit/karbon içeren hibrit anot yapıları ile akülerin çevrim ömürleri artırılmaya başlanmıştır. Pazarda otomobil starter aküleri ile yer almaya başlayan bu teknoloji geliştikçe stasyoner uygulamalarda da kullanım alanına sahip olabilecektir.
Lityum-iyon Bataryalar
Alkali bir metal olan Lityum 3 olan atom numarası ile periyodik cetvelin Hidrojen ve Helyum’dan sonra en “küçük” atomudur. Bu nedenle kimyasal reaksiyonlarda Anot-Katot arasında iyon mobilizasyonu çok kolaydır. Elektron verdiğinde -3.04V gibi diğer tüm metallerden çok daha yüksek bir E0 standart potansiyel üretme yeteneğine sahiptir.
Bu özellikleri nedeniyle Lityum özellikle şarj edilebilir (secondary) akü teknolojilerinin en tercih edilen elementlerinden biri haline gelmiştir. Lityum Metal Oksit (Li-Ion) ve Lityum Metal Fosfat tabanlı “katot” (pozitif elektrot) malzemeleri şarj edilebilir akü olarak çok yüksek enerji depolama yoğunluğu sağlayabildiği için özellikle mobil ekipmanlarda ve elektrikli vasıtalarda (EV) tercih edilen bir teknoloji olmasını sağlamıştır.
Lityum elementi doğada 31. sırada “en bol bulunan” element olarak bilinir. Dünyada özellikle Çin, Kuzey Amerika, Brezilya, Şili, Arjantin, Rusya, İspanya, Afganistan ve Afrika’nın bazı bölgelerinde madenciliği yapılmaktadır. Rezervlerinin (deniz suyundan elde edilebilecekler hariç) 28.4 Milyon ton civarında olduğu sanılmaktadır. 1.4 × 1021 kg deniz suyunda bağıl olarak 0.17 ppm oranında Lityum bulunur. Yani tüm denizlerin rezervi 200 Milyar Ton Lityum barındırır. Bu bağlamda Lityum çabuk bitecek bir element değildir.
Lityum-İyon bataryaların en çok kullanılan tipleri olan Lityum Metal Oksit Katot tipi bataryaların temel karakteristikleri
- Yüksek enerji yoğunluğu ( 270 Wh/lt, 220 Wh/kg)
- Yüksek şarj verimi, (~ %98)
- Çevrim ömrü (500-1500 çevrim @ %80 DoD )
Bu tip bataryalarda katot “lithiated metal oxide“ (LiCoO2, LiMnO4, LiNO2 vs) adı verilen maddelerden yapılır ve anot ise yüzey yapısında karbon grafit maddesinden oluşur.

Elektrolit maddesi organik karbonat (PC-Propilen Karbonat, EC-Etilen Karbonat, DMC-Dimetil Kabonat, DEC- Dietil Karbonat) içinde çözülmüş lityum tuzlarından (ör: LiPF6) . Şarj sırasında katottaki lityum atomları iyonlaşır ve elektrolit içinden geçerek karbon anoda ulaşır ve birleşir bu sırada elektronunu vererek dış devrede akım oluşturur. Bu süreç deşarjda tersine işler.
Lityum Kobalt Oksit (LiCoO2) yerine Lityum Mangan Oksit (LiMnO4) kullanıldığında Kobalt’ın yarattığı overcharge’da patlama riski ortadan kalkar. Ancak bu tip bataryalarda 50oC üzerine çıkıldığında performans çok dramatik şekilde düşmektedir. Diğer yandan, Mangan (Mn) kullanıldığında enerji yoğunluğu %20 kadar düşmektedir. Ancak Mangan Kobalt’a göre çok daha güvenli ve çevre dostu bir elementtir. Buna rağmen kobalt tabanlı Li-İyon bataryalar enerji yoğunlukları sebebiyle tercih edilmektedir.
Nikel Oksit (LiNiO2) metal kullanımda Li-İyon bataryanın enerji yoğunluğu kobalta göre %30 daha artar. Ancak buna karşılık oluşan ekzotermik reaksiyon çok daha yüksek ısı ürettiğinden Nikel tabanlı bataryalarda soğutma problemleri oluşmaktadır. Endüstride üç metalli Lityum Nikel Mangan Kobalt Oksit - Li(NiCoMn)O2 (NMC) türü de üretilmekte ve hem ucuz hem de güvenli bazı parametreler (1000-1500 Çevrim) elde edilebilmektedir. Diğer yandan çevrim ömrü düşük (500 çevrim) olsa da Nikel-Kobalt-Alüminyum Oksit - LiNiCoAlO2 (NCA) kimyası kullanılarak 200-250 Wh/kg enerji yoğunluklarına çıkılabilmekte ve "hafif" batarya gerektiren uygulamalarda NCA bataryalar öne çıkabilmektedir.
Lityum-Ferrit Fosfat (LFP) Bataryalar
Lityum-İyon bataryaların diğer bir tipi olan ve pazarda kısaca Lityum-Demir Fosfat veya Lityum Ferrit Fosfat adı verilen bu bataryalarda katot materyali lityum metal oksit yerine lityum metal fosfat malzemesinden yapılır. Metal olarak demir, kobalt, mangan veya titanyum kullanılır.
Lityum Ferrit Fosfat batarya teknolojisi 1996 yılında Texas Üniversitesinden Akshaya Padhi tarafından bilimsel olarak rapor edilmiştir. Performans ve üretim açısından en uygunlardan biri olan Lityum Demir Fosfat (LiFePO4 ) bataryalar ticari olarak seri üretime başlamıştır.
• Yüksek enerji yoğunluğu (220 Wh/lt, 100-140 Wh/kg)
• Yüksek şarj verimi, (> %90)
• Uzun çevrim ömrü (>2,000 çevrim @ %80 DoD)
• Yüksek ve düşük çalışma sıcaklıklarında iyi performans (-20 ... +55 °C)
Temel kimyasal reaksiyon : LiFe(II)PO4 <-> Fe(III)PO4 + Li + e-
Amerikan A123 firması tarafından “Nano Fosfat” halinde üretilen katot malzemesi ile performans değerlerinin daha da iyileştirildiği bildirilmektedir. Bu model katoda sahip yeni bataryalarda 5 dakikada %90 şarj kapasitesine ulaşılabilmektedir. Aynı bataryalar 7000 (%100 DoD) çevrimde ancak %20 kapasite kaybedecek kadar iyi çevrim sayılarına çıkmaktadır.
Silicone Nanowire Anotlu Lityum-Iyon Bataryalar
California Stanford Üniversitesi kimya kürsüsünden Dr. Yi Cui ve ekibi tarafından 2007’de geliştirilen bir yöntemle ortaya çıkmıştır. Klasik Lityum-İon bataryalarda karbon grafit’ten yapılan anot silikon nano teller halinde üretildiğinde, grafit veya film silikon tabanlı anotlardaki Li iyonlarının anota şarj sırasında bağlanması (lithiation) ve deşarjda ayrılması sırasında anot yüzeyinde oluşan deformasyon azaltılmaktadır.
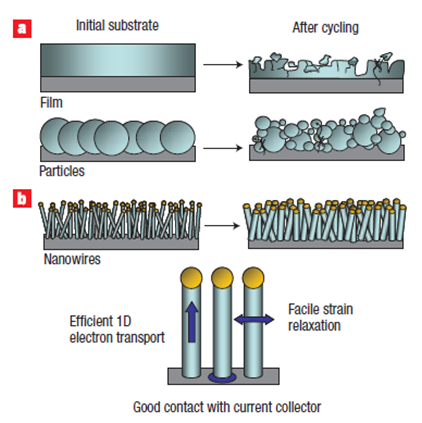
Li iyonlarının bağlandığı silisyum nano teller şişmanlamakta ve boyları uzamaktadır. Li iyonları ayrıldığında da çok yüksek oranda teller eski haline geri dönmektedir. Bu teknoloji Li-İon pillerin çok daha yüksek enerji yoğunluğuna çıkmaları (mevcutların 8-10 katı) ve çok hızlı şarj/deşarj edilebilmelerini sağlama olanağı verecektir.
Lityum-Titanat Anotlu Li-İyon Bataryalar
Lityum-İon (Li Metal Oksit) akülerde karbon-grafit’ten yapılan Anot , Lityum-Titanat (Li2TiO3)bataryalarda nanoteknoloji sayesinde “nano kristal” haline getirilmiş Lityum Titanat kristallerinden oluşur. “Altairnano” firması tarafından geliştirilen sonrasında Leclance (İsviçre) ile Toshiba, Seiko ve Yabo gibi Japon firmaların daha da ileri götürdüğü Lityum-Titanat bataryaların diğer akü tiplerine göre en temel avantajları
- Çok Yüksek enerji yoğunluğudur (7500 Wh/lt, 4000 Wh/kg, 160 Ah/Kg)
- Yüksek şarj verimi (yaklaşık %87-95)
- Çok Uzun çevrim ömrü (15,000-25,000 çevrim @ %80 derin deşarjda)
- Düşük hücre gerilimi: 2.4V nominal

Anot’ta kullanılan Lityum Titanat nano kristaller anot yüzey alanını 100 m2/gr seviyesine çıkarır. Karşılaştırmak gerekirse Li-iyon bataryalarda kullanılan grafit anotta bu oran 3m2/gr seviyesindedir. Elektrolit maddesi organik karbonat içinde çözülmüş lityum tuzları kullanılır. Şarj sırasında katotdaki Lityum atomları iyonlaşır ve elektrolit içinden geçerek Li2TiO3 anota ulaşır ve birleşir bu sırada elektronunu vererek dış devrede akım oluşturur.
Bu süreç deşarjda tersine işler. Anottaki yüzey fazlalığı bu tip akülerin çok hızlı şarj edilebilmesine yardımcı olur. Bunun yanı sıra -30 °C gibi düşük sıcaklarda bir oldukça iyi performans gösterebilmektedir. Bu teknolojinin son geldiği noktada Lityum Titanatın özel bir kristal fazı olan Li4Ti5O12 ( Lityum Titanat Spinel) nanokristaller ile mevcut Lityum Titanat hücrelerden 10-100 kat daha hızlı şarj deşarj olabilmektedir.
Lityum Sülfür Bataryalar
Lityum’dan oluşan anodun deşarj sırasında Sülfür / Kabon tabanlı katota bağlanması şeklinde reaksiyona sahip Lityum Sülfür Bataryalar bilinen en yüksek enerji yoğunluğuna sahip Lityum bataryalardır.
Katot’daki sülfürün elektrolitte çözünmesi nedeniyle oluşan sülfür eksilmesi en temel problem olduğundan bu teknolojide sülfür kaybını en aza indirgeyecek polysülfit elektrolitler üzerinde geliştirme ve katottaki karbon’un nano wire şeklinde gelişimi üzerinde başarılı çalışmalar yapılmaktadır. Ayrıca şarj ve deşarj karakteristiklerinin non-lineer olması bu akülerin mikroişlemci destekli şarj/deşarj edilmesini gerektirmektedir.
Bu tip bataryaların temel sorunu çevrim ömürlerinin diğer Lityum batarya tiplerine göre çok düşük olmasıydı. Ancak 2013 ve 2014'de yürütülen çalışmalarda enerji yoğunluğu ve güç yoğunluğundan feragat edilmek suretiyle 1500 çevrim ömürlerine (400 mAh/gr - 0.5C şarj/1C deşarj)
- Yüksek enerji yoğunluğu (300-500 Wh/kg)
- Yüksek şarj verimi, (~ %99.7)
- Düşük hücre gerilimi : 1.7-2.5V
- Ortalama çevrim ömrü: 300... 800 çevrim.

Temel kimyasal reaksiyon
Deşarj: S8 → Li2S8 → Li2S6 → Li2S4 → Li2S3
Şarj : Li2S → Li2S2 → Li2S3 → Li2S4 → Li2S6 → Li2S8 → S8
Özellikle askeri uygulamalar, taşınabilir cihazlar ve elektrikli otomobiller için üretimi düşünülmektedir.
Lityum-Hava Bataryalar (Li-Air)
Lityum ve Lityum Oksit katot/anot çiftinden oluşan bu batarya tipinde elektrolit bulunmaz. Katottaki Lityum oksidasyonu ile anottaki oksijen redüksiyonu gerekli elektron akışını sağlar. Li-Air bataryalar havadaki oksijeni kullandıkları için "oksidasyon malzemesine" gerek kalmaz ve daha az malzeme kullanıldığından enerji yoğunluğu en yüksek Lityum batarya tipleridir. 1970'lerde keşfedilen ve elektrikli otomobiller için düşünülen Li-Air bataryalar ancak 2000'li yıllarda metalürji teknolojisinin gelişmesi ile sıçrama yapabilmiştir. Li-Air bataryaların gravimetrik enerji yoğunluğu neredeyse Benzin'in enerji yoğunluğu kadardır.
Li ve LiO2 arasında sulu çözelti bulunan "Aqueous" tipleri ve arada Lityum geçirgen seramik veya polimer bulunan "Solid State" tipleri üzerinde çalışmalar halen sürmektedir. Henüz yeterli düzeyde yüksek güç yoğunluğu ve yeterli çevrim ömrüne sahip ticari ürünler piyasada görülemese de son 10 yıldır birçok batarya araştırma merkezinde Li-Air bataryalar üzerinde çalışmalar artarak sürmektedir.

Lityum-İyon Batarya Teknolojileri Karşılaştırması

Lityum Batarya Kimyalarının Parametrik Karşılaştırmaları:


Li4Ti5O12 (LTO)

LiNiMnCoO2 (NMC)

LiNiCoAl (NCA)

LiMn2O4 (LMO)

LiFePO4 (LFP)

LiCoO2 (LCO)
Kaynak: batteryuniversity.com
